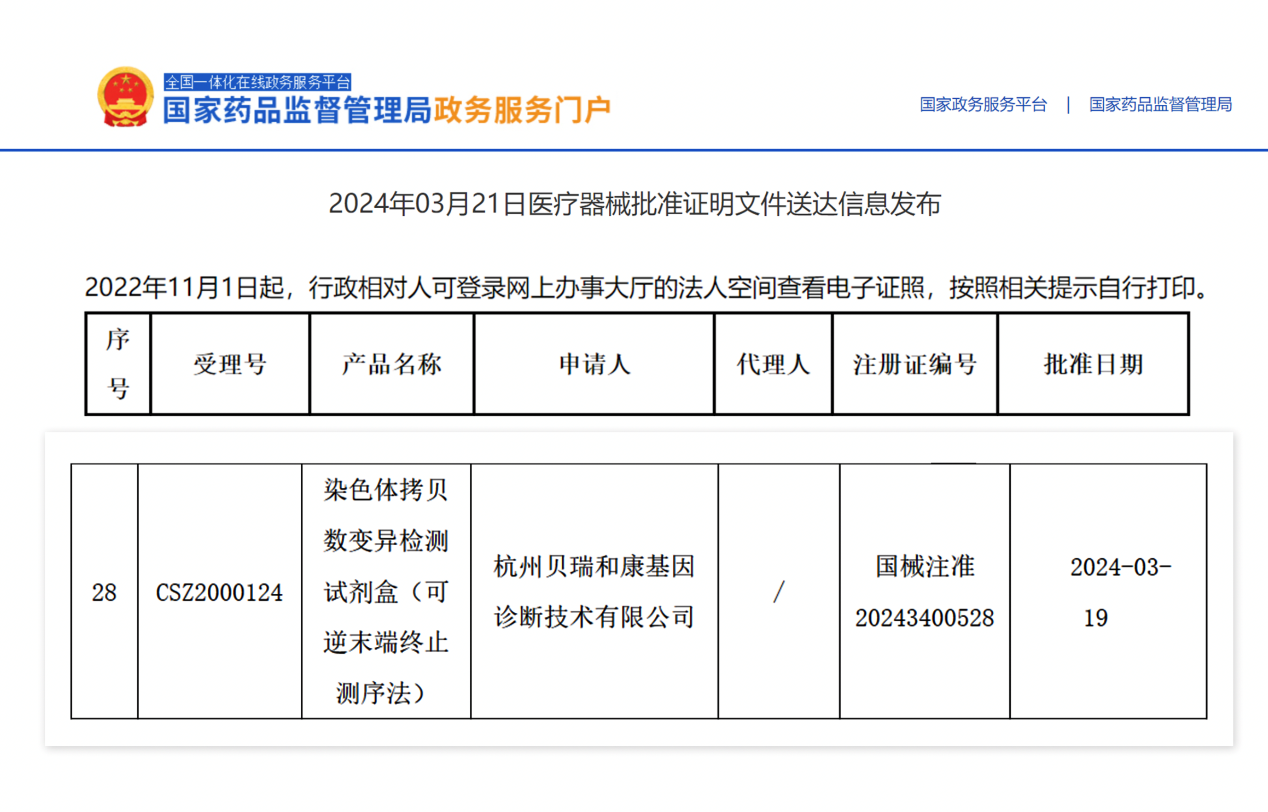
貝瑞基因CNV-seq檢測試劑盒獲國家藥品監督管理局(NMPA)批準上市!
2024年3月21日,貝瑞基因“染色體拷貝數變異檢測試劑盒(可逆末端終止測序法)”(國械注準20243400528)獲國家藥品監督管理局(NMPA)批準上市!據悉,該試劑盒適用于體外定性檢測高危孕婦羊水樣本,同時檢測染色體非整倍體及多個CNV異常情況,可為臨床提供全面、精準、高效的產前診斷解決方案!
布局產前診斷賽道十年,貝瑞先發優勢明顯
產前診斷是預防出生缺陷的重要方式,我國人口基數龐大,在高齡產婦持續增多和5.6%(《中國出生缺陷防治報告(2012)》)出生缺陷發生率的背景下,產前診斷供給量長期嚴重不足。
貝瑞基因作為國內將二代高通量測序技術應用于臨床的代表性公司,針對傳統染色體拷貝數變異的檢測方法,如核型分析、染色體微陣列分析(CMA)分別存在的周期長、分辨率低和通量低、成本高的問題,于2013年開啟CNV-seq研發及回顧性研究,貝瑞基因CNV-seq試劑盒,正是在防控新形勢下,尋求產前診斷更佳方案的突破性探索。
2019年4月,《低深度全基因組測序技術在產前診斷中的應用專家共識》的發表,將CNV-seq確認為新一代一線產前診斷技術,而貝瑞基因自主研發并取得發明專利的PCR-free建庫技術,無需擴增,是CNV-seq精準檢測的技術保證。
目前,貝瑞基因CNV-seq產品已實現從樣本處理到智能化解讀的全鏈條布局,CNVisi®原發性拷貝數變異智能化解讀系統基于ACMG最新指南,內置20+權威數據庫及百萬中國人CNV內部大數據,提升CNV-seq注釋解讀準確性及可靠性。同時,可節省臨床≥90%的操作時間,降低解讀報告工作的復雜度及難度。“軟硬件”強強結合,共同提升中國臨床產前診斷的效率,降低胎兒出生缺陷風險,緩解臨床及孕婦的壓力!
貝瑞新添一“證”,再拓發展增長極
貝瑞基因在我國生育健康領域起步較早、發展迅速、產品結構完善。NIPT產品也于2015年獲得國家藥監局批準上市。目前貝瑞基因已經布局了孕前、孕期、新生兒的出生缺陷三級預防,并在臨床得到了廣泛應用。
近些年來,貝瑞基因積極推動產前診斷合規化開展。截止目前,CNV-seq檢測服務已合作產前診斷機構超300家、累積產前診斷樣本量超500,000份,40+家權威機構實現全流程自主開展。相信隨著此次CNV-seq試劑盒的獲批上市,將再次加強貝瑞在基因測序領域的市場競爭力,對其生育健康業務將產生積極影響。
去年,貝瑞基因用于檢測染色體拷貝數變異(CNV-seq)的測序文庫構建方法和試劑盒,獲得歐洲專利局頒發的專利證書(專利種類:發明專利;專利號:EP3642400)。并與阿吉蘭兄弟醫療公司在沙特共同成立合資公司,這標志著貝瑞基因在不斷打磨技術、創新產品的同時,也為積極“出海”積蓄力量,積極尋求新的業務增長點。

